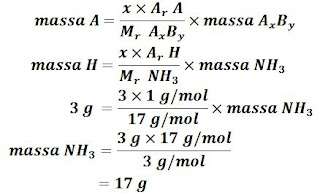Contoh Soal dan Pembahasan Lengkap Stoikoimetri Kimia (2) - Oke di malam kali ini kita akan membahas Contoh Soal dan Pembahasan Stoikoimetri Kimia bagian 2. Yang belum membaca bagian pertama bisa cek di artikel sebelumnya ya. Pada bagian 2 ini kita akan membahas soal di evaluasi bab ya, sebelumnya kita sudah pernah mencoba membahas soal yang ada di uji kemampuan. Untuk mempertajam pemahaman materi kita akan mencoba lagi dan menambah pembahasan soal tentang stoikiometri.
Soal-soal yang nanti akan kita bahas disini masih termasuk di dalam Buku Sekolah Elektronik (BSE) serta sedikit tambahan dari buku lain yang relevan.
Soal Evaluasi BAB Stoikiometri
Seperti yang sudah dikatakan di awal, kita akan membahas soal yang ada di evaluasi bab, tetapi tidak semua kita bahas melainkan memilih soal tertentu untuk di bahas. Di ingatkan kembali bagi teman Sains Seru yang ingin soalnya di bahas disini bisa langsung mengirimkannya ke sini dengan cara meninggalkan di kolom komentar atau langsung di contact email yang tertera di website ini. Soal bisa berupa teks atau gambar biar bisa lebih mudah mengirimnya.
Soal No 6.
Perbandingan massa N : H dalam NH₃ adalah 14 : 3. Jika hidrogen yang terdapat dalam NH₃ = 3 gram, maka massa NH₃ adalah ...
Ditanya: massa NH₃ = ...?
Untuk menjawab soal di atas kita bisa menggunakan Hukum Proust. Cara penyelesaian adalah sebagai berikut.
(Ar N = 14, Ar H = 1)
Mr NH₃ = (Ar N) + (3 × Ar H)
= 14 + (3 × 1)
= 14 + 3
= 17 g/mol
Jadi, massa NH₃ adalah 17 gram.
Soal No 7.
Perbandingan massa kalsium dan massa oksigen membentuk kalsium oksida adalah 5 : 2. Jika 10 g kalsium di reaksikan dengan 5 g oksigen, massa kalsium oksida yang terbentuk adalah ...
massa O = 5 g
Ditanya: massa CaO = ...?
Jawab
Diketahui: massa H = 3 gDitanya: massa NH₃ = ...?
Untuk menjawab soal di atas kita bisa menggunakan Hukum Proust. Cara penyelesaian adalah sebagai berikut.
(Ar N = 14, Ar H = 1)
Mr NH₃ = (Ar N) + (3 × Ar H)
= 14 + (3 × 1)
= 14 + 3
= 17 g/mol
Jadi, massa NH₃ adalah 17 gram.
Soal No 7.
Perbandingan massa kalsium dan massa oksigen membentuk kalsium oksida adalah 5 : 2. Jika 10 g kalsium di reaksikan dengan 5 g oksigen, massa kalsium oksida yang terbentuk adalah ...
Jawab
Diketahui: massa Ca = 10 gmassa O = 5 g
Ditanya: massa CaO = ...?
(Ar Ca = 40, Ar O = 16)
Mr CaO = (Ar Ca) + (Ar O)
= 40 + 16
= 56 g/mol
= 40 + 16
= 56 g/mol
Dengan cara yang sama kita dapat menyelesaikan soal diatas, tetapi kita harus mencari pereaksi pembatas terlebih dahulu karena terdapat 2 buah massa di pereaksi. Cara penyelesaian adalah sebagai berikut.
Persamaan rekasinya adalah.
Ca + O → CaO [setara]
Baca juga: Pereaksi pembatas.
Soal No 8.
Sebanyak 5 L gas hidrogen direaksikan dengan gas klorin dan menghasilkan gas hidrogen klorida (HCl) maka volume gas HCl yang dihasilkan pada P dan T yang sama adalah ...
Jawab
Persamaan reaksi.
H₂ + Cl₂ → 2HCl [setara]
Untuk mengetahui volume HCl kita bisa menggunakan rumus perbandingan koefisien = perbandingan volume.
Soal No 9.
Jika 750 cm³ gas hidrogen direaksikan dengan gas hidrogen direaksikan dengan gas nitrogen untuk membentuk amonia.
N₂(g) + H₂(g) → NH₃(g)
Volume gas amonia yang dihasilkan adalah ...
Jawab
Persamaan reaksi: N₂(g) + 3H₂(g) → 2NH₃(g) [setara]
Untuk mengetahui volume gas NH₃ kita bisa menggunakan rumus perbandingan koefisien = perbandingan volume.
Soal No 10.
Pada suhu dan tekanan yang tetap 1 mol gas oksigen bervolume 50 dm³. Jumlah atom dalam 10 dm³ gas metana pada suhu dan tekanan tersebut adalah ...
V O₂ = 50 dm³
V CH₄ = 10 dm³
Jawab
Diketahui: mol O₂ = 1 molV O₂ = 50 dm³
V CH₄ = 10 dm³
Ditanya: JP = ...?
Karena di soal diberikan suhu dan tekanan yang sama maka kita bisa menggunakan rumus gas ideal dengan P dan T bisa di abaikan seperti dibawah ini:
PV = nRT
V = nR
R = V/n
Karena R₁ = R₂
V₁/n₁ = V₂/n₂
Setelah kita mendapat nilai mol, kemudian kita bisa menggunakan rumus Jumlah Partikel seperti pada artikel sebelumnya.
JP = n × 6.10²³
= 0,2 × 6.10²³
= 1,2.10²³
Jadi, jumlah atom gas metana adalah 1,2.10²³.
Baca juga: Rumus jumlah partikel, mol, volume STP.
Soal No 11.
Sebanyak 5,6 L gas CO₂ pada STP memiliki jumlah molekul sebanyak ...
Jawab
Kita bisa menggunakan rumus volume STP dan jumlah partikel, sebagai berikut.
Jadi, jumlah molekul gas CO₂ pada STP adalah 1,5.10²³.
Soal No 12.
Pada keadaan standar 1,12 L gas X massanya 1,5 g. Massa molekul relatif gas X adalah ...
Jawab
Kita bisa menggunakan rumus volume STP dan mol, untuk mencari nilai dari massa molekul relatif gas X sebagai berikut.
Jadi, massa molekul relatif gas X adalah 30.
Soal No 13.
Pada suhu dan tekanan tertentu, 0,5 L gas NO (Mr = 30) massanya 1,5 g. Jika pada suhu dan tekanan yang sama 49 g KClO₃ (Mr = 122,5) dipanaskan, dengan reaksi: KClO₃(s) → KCl(s) + O₂(g). Volume gas oksigen yang dihasilkan adalah ...
Jawab
Persamaan reaksi: 2KClO₃(s) → 2KCl(s) + 3O₂(g) [setara]
Kita bisa menggunakan rumus mol, gas ideal, dan perbandingan koefisien = perbandingan volume.
Jadi, volume gas oksigen yang dihasilkan adalah 6 L.
Soal No 14.
Suatu senyawa hidrokarbon mengandung 94,1 % massa karbon dan 5,9 % massa hidrogen. Rumus empiris senyawa ini adalah ...
Jawab
Soal diatas bisa diselesaikan dengan menggunakan rumus empiris, sebagai berikut.
Jadi, Rumus empiris senyawa ini adalah C₈H₆.
Soal No 15.
Suatu senyawa memiliki rumus empiris CH₂. Jika massa molekul relatif senyawa tersebut adalah 70, maka rumus molekulnya adalah ...
Jawab
Soal diatas bisa diselesaikan dengan menggunakan rumus molekul, sebagai berikut.
Mr CH₂ = (Ar C) + (2 × Ar H)
= 12 + 2
= 14 g/mol
= 12 + 2
= 14 g/mol
(Mr CH₂)n = Mr
(14)n = 70
n = 5
5(CH₂) = C₅H₁₀
Jadi, Rumus empiris senyawa ini adalah C₅H₁₀.
Contoh Soal dan Pembahasan Lengkap Stoikoimetri Kimia (2) - Sekian dulu ya Contoh Soal dan Pembahasan Stoikoimetri Kimia no 6 sampai 15. Semoga pembahasan diatas dapat bermanfaat bagi teman setia Sains Seru. Jika ada yang kurang jelas bisa ditanyakan di kolom komentar dibawah ya. Kita akan melanjutkan ke soal-soal lain jadi ikuti terus ya update artikel disini ya. Terimakasih atas perhatiannya, See You.