Keunikan Atom Karbon dalam Senyawa Hidrokarbon - Setelah sebelumnya kita sudah mengenal apa itu senyawa hidrokarbon, pada pertemuan kali ini kita akan mencoba membahas tentang Keunikan Atom Karbon dalam Senyawa Hidrokarbon. Atom karbon ini memang memiliki keunikan tersendiri dari atom lainnya. Pada kehidupan sehari-hari kita pasti sering menggunakan bahan bakar seperti arang kayu, bensin, gas elpiji, batu bara, minyak tanah, solar dan lainnya yang dimana itu terdapat senyawa hidrokarbon. Selain itu juga lilin, aspal jalan, plastik, nasi, roti dan masih banyak lagi itu terdapat senyawa hidrokarbon di dalamnya. Sehingga bisa dikatakan sebagian besar dari senyawa kimia di alam ini adalah senyawa karbon, hal ini lah yang menjadi keunikan tersendiri dari atom karbon tersebut. Adapun keunikan dari atom karbon adalah sebagai berikut:
1. Atom C Berikatan dengan Atom H Membentuk Hidrokarbon
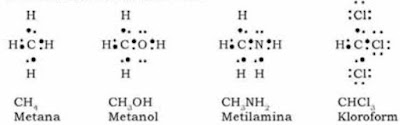
Kita ketahui bersama bahwa atom C terletak pada periode 2 dan golongan IV A sehingga memiliki konfigurasi elektron 2 4 sehingga elektron valensinya adalah 4. Oleh karena itu, dalam kaidah oktet maka atom C dapat mengikat 4 atom H (elektron valensi 1) membentuk ikatan kovalen. Berdasarkan struktur geometri dan struktur lewis atom C yang berikatan dengan atom H membentuk senyawa hidrokarbon dapat dilihat pada gambar dibawah ini.
Selain berikatan dengan atom H, atom C juga dapat berikatan dengan atom lainnya seperti atom O, atom N, atom Cl dan lain sebagainya.
2. Atom C berikatan dengan atom O Membentuk Karboksida
Seperti yang disebutkan diatas atom C juga bisa berikatan dengan atom O dan membentuk senyawa karboksida. Atom C yang memiliki elektron valensi 4 dan atom O yang memiliki elektron valensi 6 dapat mencapai stabil jika atom C memerlukan 4 elektron sedangkan atom O dua elektron. Empat elektron yang dibutuhkan atom C berasal dari 2 atom O yang masing-masing memberikan 2 elektron untuk mencapai kestabilan. Penggabungan atom C dan atom O dapat dilihat pada gambar berikut ini.
3. Ikatan Antaratom C Membentuk Rantai Karbon
Atom C yang memiliki elektron valensi 4 dapat juga berikatan dengan sesama atom C lainnya. Inilah keunikan dari atom C sehingga dapat membentuk rantai karbon yang panjang. Rantai karbon tersebut dapat berupa ikatan tunggal, ikatan rangkap, atau ikatan rangkap tiga. Bentuk yang dihasilkan rantai karbon ada yang berbentuk lurus, ada yang bercabang, ada yang terbuka, dan ada juga yang tertutup (membentuk lingkaran). Berikut berbagai bentuk rantai karbon yang ada seperti pada gambar.
Berdasarkan jumlah atom C yang berikatan, terdapat 4 kemungkinan posisi atom C pada rantai karbon, yaitu atom C primer, atom C sekunder, atom C tersier, dan atom C kuartener. Atom C primer merupakan atom C yang hanya mengikat 1 atom C lainnya. Atom C sekunder merupakan atom C yang hanya mengikat 2 atom C lainnya. Atom C tersier merupakan atom C yang hanya mengikat 3 atom C lainnya. Atom C kuartener merupakan atom C yang hanya mengikat 4 atom C lainnya.
Contoh soal 1.
Perhatikanlah struktur senyawa hidrokarbon berikut
Atom C yang ditunjukkan oleh tanda panah merupakan:
a. Atom C primer
b. Atom C sekunder
c. Atom C tersier
d. Atom C kuartener
Jawab
a. Atom C primer ditunjukkan angka A dan E.
b. Atom C sekunder ditunjukkan angka D.
c. Atom C tersier ditunjukkan angka C.
d. Atom C kuartener ditunjukkan angka B.
Senyawa rantai terbuka biasa disebut senyawa alifatik, sedangkan senyawa tertutup (melingkar) disebut senyawa siklik. Senyawa tunggal (C - C) disebut senyawa karbon jenuh, sedangkan senyawa yang memiliki ikatan rangkap dua (C = C) dan tiga (C ≡ C) disebut senyawa karbon tidak jenuh. Senyawa-senyawa tersebut sudah pernah kita bahas pada pertemuan sebelumnya.
Baca juga: Senyawa Hidrokarbon.
Kemampuan atom karbon dapat dengan mudah berikatan dan mengikuti kaidah oktet berbeda dengan atom lainnya, walaupun atom lain berada pada golongan yang sama. Misalnya berikatan dengan atom boron dan atom nitrogen dengan konfigurasi elektron masing-masing ₅B = 2 3 dan ₇N = 2 5. Dari konfigurasi elektron tersebut atom boron memiliki elektron valensi 3 dan nitrogen memiliki elektron valensi 5. Berikut ini struktur lewis dari senyawa BH₃ dan NH₃.
Jadi, senyawa BH₃ dan NH₃ hanya memiliki tiga ikatan kovalen. Jika atom C berikatan dengan silikon yang memiliki konfigurasi elektron 2 8 4. Dari konfigurasi elektron tersebut maka silikon memiliki elektron valensi 4. Perhatikanlah struktur lewis dari ikatan atom C dan atom Si sebagai berikut.
Jika diperhatikan dari struktur lewis senyawa SiH₄ dan SiO₂, struktur tersebut sama dengan senyawa CH₄ dan CO₂. Perbedaan SiH₄ dengan CH₄ terletak pada kulitnya, jika atom silikon terletak pada kulit ketiga sedangkan karbon terletak pada kulit kedua. Sehingga jari-jari atom Si lebih besar dari atom C. Jadi, ikatan Si - H pada senyawa SiH₄ lebih lemah dibanding dengan ikatan C - H pada senyawa CH₄.
Keunikan Atom Karbon dalam Senyawa Hidrokarbon - Demikianlah pembahasan singkat dari materi Keunikan Atom Karbon dalam Senyawa Hidrokarbon. Semoga pembahasan diatas bisa membantu teman setia Sains Seru ya. Jangan lupa juga untuk selalu mengikuti update artikel disini ya. Terimakasih juga sudah menyimak sampai pada akhir materi, sampai jumpa pada pertemuan selanjutnya. See You.