Cara Mudah Menentukan Persamaan Reaksi Redoks - Setelah sebelumnya kita sudah pernah membahas unsur-unsur biloks dalam suatu senyawa. Pada kesempatan kali ini kita akan mencoba membahas tentang Cara Menentukan Persamaan Reaksi Redoks. Pembahasan kali ini kita akan mencari apakah persamaan yang diberikan itu termasuk dalam persamaan reaksi redoks atau bukan. Materi ini juga sering muncul pada SBMPTN, maka dari itu teman Sains Seru ikuti ya pembahasan dibawah yang semoga bisa membantu. Pada persamaan reaksi redoks pastinya akan terjadi perubahan nilai biloks pada unsur-unsur yang sejenis.
Persamaan Reaksi Redoks
Seperti yang sudah dijelaskan diatas, dikatakan persamaan tersebut dalam persamaan reaksi redoks maka persamaan tersebut harus mengalami perubahan bilangan oksidasi (biloks). Perhatikan contoh reaksi redoks dibawah ini.
Reaksi oksidasi: 4Na → 4Na⁺ + 4e⁻
Reaksi reduksi: O₂ + 4e⁻ → 2O²⁻
Reaksi redoks: 4Na + O₂→ 4Na⁺ + 2O²⁻
Pada reaksi oksidasi diatas, atom Na memiliki biloks 0 yang berubah menjadi ion Na⁺ dengan biloks +1. Perubahan bilangan oksidasi Na dari 0 menjadi +1 menunjukkan bahwa telah terjadi kenaikan bilangan oksidasi. Jadi, pada reaksi oksidasi terjadi kenaikan bilangan oksidasi.
Pada reaksi reduksi atom O yang memiliki biloks 0 berubah menjadi ion O²⁻ dengan biloks -2. Perubahan bilangan oksidasi O dari 0 menjadi -2 menunjukkan bahwa telah terjadi penurunan bilangan oksidasi. Jadi, pada reaksi reduksi terjadi penurunan bilangan oksidasi.
Untuk lebih memudahkan lagi, kita akan berikan skema perubahan biloks yang terjadi pada persamaan redoks diatas ke dalam bentuk gambar. Skema perubahan biloks persamaan reaksi redoks adalah sebagai berikut.
Contoh soal 1.
Perhatikanlah contoh persamaan reaksi redoks berikut ini. Tentukanlah persamaan tersebut termasuk ke dalam reaksi redoks atau bukan.
a. NaOH + HCl → NaCl + H₂O
b. 2KMnO₄ + 16HCl → 2MnCl₂ +2KCl + 5Cl₂ + 8H₂O
c. 2K + 2H₂O → 2KOH + H₂
d. CuO + 2HNO₃ → Cu(NO₃)₂ + H₂O
e. CaCO₃ → CaO + CO₂
Jawab
a. Persamaan a diatas adalah bukan reaksi redoks. Itu terjadi karena pada reaksi tersebut tidak terjadi perubahan bilangan oksidasi pada unsur-unsur yang terlibat di dalam reaksi tersebut. Perubahan biloks pada persamaan a adalah sebagai berikut.
b. Persamaan b diatas adalah reaksi redoks. Itu terjadi karena pada atom Mn mengalami perubahan bilangan oksidasi dari +7 turun menjadi +2, dan pada atom Cl dari -1 naik menjadi 0. Perubahan biloks pada persamaan a adalah sebagai berikut.
c. Persamaan c diatas adalah reaksi redoks. Itu terjadi karena pada atom K mengalami perubahan bilangan oksidasi dari 0 naik menjadi +1, dan pada atom H dari +1 turun menjadi 0. Perubahan biloks pada persamaan a adalah sebagai berikut.
d. Persamaan d diatas adalah bukan reaksi redoks. Itu terjadi karena pada reaksi tersebut tidak terjadi perubahan bilangan oksidasi pada unsur-unsur yang terlibat di dalam reaksi tersebut. Perubahan biloks pada persamaan a adalah sebagai berikut.
e. Persamaan e diatas adalah bukan reaksi redoks. Itu terjadi karena pada reaksi tersebut tidak terjadi perubahan bilangan oksidasi pada unsur-unsur yang terlibat di dalam reaksi tersebut. Perubahan biloks pada persamaan a adalah sebagai berikut.
Reaksi Autoredoks (Reaksi Disproporsionasi)
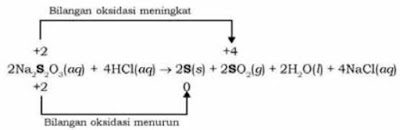
Suatu persamaan reaksi dikatakan reaksi autoredoks atau reaksi disproporsionasi jika terdapat suatu zat yang mengalami reaksi reduksi dan reaksi oksidasi sekaligus. Jadi, reaksi autoredoks atau reaksi disproporsionasi adalah reaksi yang mengalami kenaikan sekaligus penurunan bilangan oksidasi. Salah satu contohnya adalah sebagai berikut.
Pada reaksi diatas, bilangan oksidasi atom S mengalami dua jenis perubahan bilangan oksidasi yaitu kenaikan dan penurunan. Jadi, reaksi diatas termasuk ke dalam reaksi autoredoks.
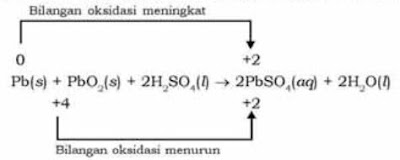
Perhatikan persamaan reaksi di bawah ini, apakah termasuk ke dalam reaksi autoredoks atau bukan.
Reaksi diatas bukan reaksi autoredoks. Karena atom Pb yang memiliki bilangan oksidasi 0 mengalami kenaikan bilangan oksidasi menjadi +2 . Kemudian atom Pb yang memiliki biloks +4 mengalami penurunan bilangan oksidasi menjadi +2. Dalam hal ini bukan reaksi autoredoks karena bilangan oksidasi yang mengalami kenaikan dan penurunan terjadi pada senyawa hasil reaksi bukan senyawa pereaksi.
Oksidator dan Reduktor
Di dalam suatu reaksi redoks akan selalu terjadi reaksi reduksi dan reaksi oksidasi. Reduktor (pereduksi) adalah zat yang dapat menyebabkan zat lain mengalami reaksi oksidasi, sedangkan oksidator (pengoksidasi) adalah zat yang dapat menyebabkan zat lain mengalami reaksi reduksi. Agar lebih mudah memahaminya maka kita berikan contoh soal beserta pembahasannya dibawah ini.
Contoh soal 2.
Perhatikanlah persamaan reaksi redoks dibawah ini. Manakah yang bertindak sebagai reduktor dan oksidator masing-masing persamaan dibawah ini.
a. 2AgCl + Ni → 2Ag + NiCl₂
b. Zn + 2HCl → ZnCl₂ + H₂
Jawab
a. Langkah pertama kita menentukan manakah yang bertindak sebagai reaksi reduksi dan reaksi oksidasi. Reaksi reduksi dan oksidasi dapat dicari dengan menentukan masing-masing atom dengan bilangan oksidasi. Penentuan bilangan oksidasi sudah pernah kita bahas pada artikel sebelumnya ya. Reaksi reduksi dan oksidasi kurang lebih seperti pada gambar di bawah ini.
Maka yang bertindak sebagai Reduktor (pereduksi) adalah Ni dan yang bertindak sebagai oksidator (pengoksidasi) adalah AgCl.
b. Langkah pertama kita menentukan manakah yang bertindak sebagai reaksi reduksi dan reaksi oksidasi. Reaksi reduksi dan oksidasi dapat dicari dengan menentukan masing-masing atom dengan bilangan oksidasi. Penentuan bilangan oksidasi sudah pernah kita bahas pada artikel sebelumnya ya. Reaksi reduksi dan oksidasi kurang lebih seperti pada gambar di bawah ini.
Maka yang bertindak sebagai Reduktor (pereduksi) adalah Zn dan yang bertindak sebagai oksidator (pengoksidasi) adalah HCl.
Cara Mudah Menentukan Persamaan Reaksi Redoks - Demikianlah materi singkat Menentukan Persamaan Reaksi Redoks. Semoga materi diatas bisa bermanfaat ya bagi teman setia Sains Seru. Jika ada yang kurang jelas bisa langsung bertanya di kolom komentar ya. Terimakasih ya atas perhatiannya, kita akan terus mengupdate materi disnimaka dari itu jangan lupa untuk selalu mengikuti artikel disini terus ya. See You.




1 comments:
Click here for commentsHarrah's Cherokee Casino - Jackson County - KTH
Harrah's Cherokee Casino has 1,084 오산 출장샵 sq ft 대구광역 출장마사지 of gaming space, 김천 출장샵 60 table games, a bowling alley, a seasonal outdoor bet365 pool, and 3 restaurants. 전라북도 출장샵 There are 17,716 slot