Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10 - Selamat sore teman-teman Sains Seru, kali ini kita akan mencoba membahas tentang Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10. Baik biar tidak terlalu lama kita akan langsung masuk ke dalam pembahasanya ya, maka simak sampai selesai ya pasti tidak akan rugi deh mengikuti pembahasan ini.
 |
| Google Image - Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10 |
Pertama-tama bagi teman-teman yang baru lulus dalam jenjang SMP sudah paham dengan materi kimia tetapi kadar atau dosisnya masih sedikit bukan. Nah di SMA ini materi kimia akan dibahas sedikit lebih mendalam lagi. Kit dalam kehidupan sehari-hari sering mendengar kata satuan dosin, gros, rim, atau kodi untuk menyatakan dalam jumlah benda. Didalam partikel biasanya dinyatakan dalam satuan mol.
Satuan mol sekarang dinyatakan dalam jumlah partikel (atom, molekul, atau ion) dalam suatu zat. Para ahli di dunia telah sepakat bahwa dikatakan satu mol zat terkandung jumlah partikel dalam 12 gram isotop C-12 yakni 6,02 × 10²³ partikel. Jumlah partikel ini biasa disebut Bilangan Avogadro (NA = Number Avogadro) atau dalam bahasa Jerman Bilangan Loschmidt (L).
Rumus Mol dalam Perhitungan Kimia Kelas 10
Mol adalah besaran dimana 1 mol zat menyatakan zat yang terkandung jumlah partikelnya sama dengan jumlah partikel yang ada di dalam 12 gram isotop C-12.
Misalnya:
1. 1 mol unsur Na mengandung 6,02 × 10²³ atom Na.
2. 1 mol senyawa air mengandung 6,02 × 10²³ molekul air.
3. 1 mol senyawa ion NaCl mengandung 6,02 × 10²³ ion Na⁺ dan 6,02 × 10²³ ion Cl⁻.
1. Hubungan Mol dengan Jumlah Partikel
Hubungan mol dengan jumlah partikel dapat ditulis secara matematis sebagai berikut:
 |
| Google Image - Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10 |
Contoh 1.
Suatu sampel mengandung 1,505 × 10²³ molekul Cl₂, berapa mol kandungan Cl₂ tersebut?
Jawab
2. Hubungan Mol dengan Massa
Sebelum masuk ke dalam hubungan mol dengan massa terlebih dahulu akan diperkenalkan Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr).
a. Massa Atom Relatif (Ar)
Massa Atom Relatif (Ar) adalah perbandingan massa rata-rata suatu atom unsur terhadap 1/12 massa satu atom isotop C-12. Di alam bebas pada umumnya unsur-unsur terdiri atas campuran isotop, sehingga massa atomnya dapat diambil rata-rata dari campuran isotopnya itu sendiri.
Contoh:
Dialam terdapat campuran ³⁵Cl dan ³⁷Cl dengan perbandingan 75% dan 25%.
Ar Cl = (75% × 35) + (25% × 37) = 35,5.
Sebenarnya nilai-nilai dari Massa Atom Relatif (Ar) sudah ada di tabel periodik unsur, teman-teman tinggal melihat nilai tersebut atau jika di dalam soal biasanya nilai tersebut akan diberikan dengan soal tersebut. Tetapi jika tidak maka kita tinggal perbanyak mengerjakan soal dengan sendirinya nilai Ar unsur tersebut akan teringat.
b. Massa Molekul Relatif (Mr)
Massa Molekul Relatif (Mr) adalah perbandingan massa massa rata-ratasatu molekul suatu senyawa terhadap 1/12 massa 1 atom isotop C-12. Secara matematis dapat dituliskan sebagai berikut:
Mr = ∑ Ar
Contoh 2.
Hitunglah nilai Mr H₂SO₄ (Ar H = 1, S = 32, O = 16)!
Jawab
Mr H₂SO₄ = (2 × Ar H) + (1 × Ar S) + (4 × Ar O)
= (2 × 1) + (1 × 32) + (4 × 16)
= 2 + 32 + 64
= 98
Kita sudah sedikit paham nih dengan Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr). Sekarang kita coba tuliskan rumus hubungan mol dengan massa, secara matematis dapat ditulis sebagai berikut:
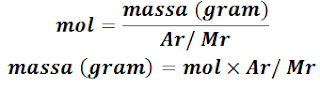 |
| Google Image - Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10 |
Contoh 3.
Berapa gram besarnya massa massa dari 3 mol gas CO₂? (Ar C = 12 dan Ar O = 16)
Jawab
Mr CO₂ = (1 × Ar C) + (2 × Ar O)
= (1 × 12) + (2 × 16)
= 12 + 32
= 44
Massa CO₂ = mol × Mr
= 3 × 44
= 132 gram
3. Hubungan Mol dengan Volume
Hubungan mol dengan volume terdapat 2 jenis yaitu gas dalam keadaan standar (STP) dan gas dalam keadaan nonstandar.
a. Gas dalam keadaan Standar (STP)
Pengukuran Gas dalam keadaan Standar (STP) tergantung dari suhu dan tekanan gas. Jika gas diukur dengan keadaan standar, maka volumenya disebut volume standar. Dikatakan gas dalam keadaan standar ketika gas tersebut memiliki suhu 0ºC (273K) dan tekanan 1 atm (atmosfer) (76 cmHg) biasa disebut STP (Standard Temperature and Pressure). Secara matematis dapat dituliskan rumusnya sebagai berikut:
 |
| Google Image - Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10 |
Contoh 4.
Hitung massa dari 4,48 liter gas C₂H₂ yang diukur dalam keadaan standar!
Jawab
Mr C₂H₂ = (2 × Ar C) + (2 × Ar H)
= (2 × 12) + (2 × 1)
= 24 + 2
= 26
Massa C₂H₂ = mol × Mr
= 0,2 × 26
= 5,2 gram
b. Gas dalam keadaan nonStandar
Jika volume gas diukur pada keadaan ATP (Ambient Temperature and Pressure) atau lebih dikenal dengan non-STP maka dapat menggunakan rumus seperti dibawah ini:
PV = nRT
Dimana:
P = Tekanan (atm atau atmosfer)
V = Volume (liter)
n = Mol (mol)
R = Tetapan gas (0,082 liter atm mol⁻¹K⁻¹)
T = Suhu (K atau kelvin)
Cara Menyelesaikan Soal Mol dalam Perhitungan Kimia Kelas 10 - Oke cukup itu dulu ya, untuk Perhitungan dalam reaksi kimia dan Pereaksi Pembatas kita akan bahas di artikel selanjutnya. Maka dari itu selalu ikuti ya update artikel disini ya. Jka teman-teman masih ada yang bingung bisa masukkan komentar dibawah ini untuk bisa saling sharing dan saling membantu satu sama lain. Terimakasih atas perhatian teman-teman Sains Seru, semoga ilmu diatas dapat bermanfaat. Jangan lupa untuk melihat artikel kami yang lain ya. See you thanks.

