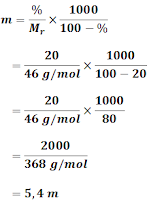Materi Lengkap Molalitas dan Fraksi Mol Beserta Contohnya - Selamat pagi teman Sains Seru, ketemu lagi nih. Kali ini kita akan membahas materi Kimia tentang Molalitas dan Fraksi Mol. Sebelumnya kita telah membahas materi tentang Molaritas, sekarang ini kita akan kelanjutan dari itu yaitu tentang Molalitas dan Fraksi Mol. Maka dari itu simak baik-baik ya pembahasan dibawah ini.
Dalam larutan, terdapat beberapa sifat zat yang hanya ditentukan oleh banyaknya partikel zat terlarut. Sifat ini disebut sebagai sifat koligatif larutan. Oleh karena itu sifat koligatif larutan ditentukan oleh banyaknya partikel zat terlarut.
Molalitas dan Fraksi Mol
Konsentrasi larutan yang dipelajari kali ini yaitu molalitas dan fraksi mol, sedangkan untuk molaritas sudah pernah dibahas sebelumnya.
a. Molalitas
Molalitas (kemolalan) adalah konsentrasi larutan yang menyatakan jumlah mol zat terlarut yang terdapat dalam 1.000 gram pelarut. Misalnya larutan dibuat dari 1 mol NaCl yang dilarutkan ke dalam 1.000 gram pelarut (air) bisa juga disebut sebagai larutan 1 molal atau 1 m NaCl. Secara matematis rumus dari molalitas adalah sebagai berikut.
Keterangan: m = molalitas (mol/kg)
Mr = massa molar zat terlarut (g/mol)
massa = massa zat terlarut (gram)
p = massa zat pelarut
Molalitas juga memiliki manfaat lain, seperti pelarut yang dimana merupakan padatan (solid) pada suhu kamar hanya bisa diukur nilai massanya, bukan nilai dari volumenya sehingga tidak dapat dinyatakan ke dalam bentuk molaritas. Molalitas juga dapat dinyatakan dalam % seperti berikut ini.
Contoh 1.
Sebanyak 30 gram urea C₆H₁₂O₆ (Mr = 60 g/mol) dilarutkan ke dalam 100 gram air. Hitunglah molalitas larutan
Mr = 60 g/mol
massa pelarut = 100 gram = 0,1 kg
Jadi, molalitas larutan 30 gram urea C₆H₁₂O₆ adalah 5 m.
Contoh 2.
Berapakah massa NaCl yang harus dilarutkan ke dalam 500 gram pelarut (air) untuk menghasilkan larutan sebesar 0,15 m?
molalitas = 0,15 m
Mr NaCl = Ar Na + Ar Cl
= 23 + 35,5
= 58,5
Jadi, massa NaCl yang harus dilarutkan pada 500 gram air untuk menghasilkan larutan 0,15 m adalah 4,3875 gram.
Contoh 3.
Molalitas suatu larutan 20% berat C₂H₅OH (Mr = 46 g/mol) adalah ...
A. 6,4 m D. 3,4 m
B. 5,4 m E. 0,4 m
C. 4,4 m
Mr = 46 g/mol
Jadi, kemolalan larutan 20% berat C₂H₅OH adalah (B). 5,4 m.
(UMPTN 1998)
Contoh 4.
Berapakah kemolalan dari larutan 10% (w/ w) NaCl (Mr NaCl = 58,5) (w/ w = persen berat)?
Diketahui: % = 10%
Mr = 58,5 g/mol
Sebanyak 30 gram urea C₆H₁₂O₆ (Mr = 60 g/mol) dilarutkan ke dalam 100 gram air. Hitunglah molalitas larutan
Jawab
Diketahui: massa urea = 30 gramMr = 60 g/mol
massa pelarut = 100 gram = 0,1 kg
Jadi, molalitas larutan 30 gram urea C₆H₁₂O₆ adalah 5 m.
Contoh 2.
Berapakah massa NaCl yang harus dilarutkan ke dalam 500 gram pelarut (air) untuk menghasilkan larutan sebesar 0,15 m?
Jawab
Diketahui: massa pelarut = 500 grammolalitas = 0,15 m
Mr NaCl = Ar Na + Ar Cl
= 23 + 35,5
= 58,5
Jadi, massa NaCl yang harus dilarutkan pada 500 gram air untuk menghasilkan larutan 0,15 m adalah 4,3875 gram.
Contoh 3.
Molalitas suatu larutan 20% berat C₂H₅OH (Mr = 46 g/mol) adalah ...
A. 6,4 m D. 3,4 m
B. 5,4 m E. 0,4 m
C. 4,4 m
Jawab
Diketahui: % = 20%Mr = 46 g/mol
Jadi, kemolalan larutan 20% berat C₂H₅OH adalah (B). 5,4 m.
(UMPTN 1998)
Contoh 4.
Berapakah kemolalan dari larutan 10% (w/ w) NaCl (Mr NaCl = 58,5) (w/ w = persen berat)?
Jawab
Larutan 10% (w/ w) → w berasal dari kata weight.Diketahui: % = 10%
Mr = 58,5 g/mol
Jadi, larutan 10% (w/ w) NaCl memiliki konsentrasi 1,9 m.
2. Fraksi Mol
Fraksi mol adalah suatu konsentrasi yang semua komponen larutannya dinyatakan berdasarkan mol. Fraksi mol komponen i dilambangkan dengan xi adalah jumlah mol komponen i dibagikan dengan mol total atau mol keseluruhan dalam larutan. Fraksi mol j adalah xj akan begitu seterusnya. Secara matematis rumusnya adalah sebagai berikut.
Contoh 5.
Larutan glukosa dibuat dengan melarutkan 18 gram glukosa (Mr = 180 g/mol) ke dalam 250 gram air. Hitunglah fraksi mol glukosa.
Jawab
Diketahui: massa glukosa = 18 gram
Mr glukosa = 180 g/mol
Mr glukosa = 180 g/mol
massa pelarut = 250 gram
Contoh 6.
Berapakah fraksi mol dan persen mol yang dihasilkan pada setiap komponen dari campuran 0,2 mol O₂ dan 0,5 mol N₂?
Jawab
% mol O₂ = 0,29 × 100% = 29%
% mol N₂ = 0,71 × 100% = 71%
Jadi, fraksi mol O₂ adalah 0,29 dan fraksi mol N₂ adalah 0,71, sedangkan persen mol O₂ adalah 29% dan persen mol N₂ adalah 71%.
Contoh 7.
Fraksi mol suatu larutan metanol CH₃OH dalam air adalah 0,5. Konsentrasi metanol dalam larutan ini dinyatakan dalam persen berat adalah ...
A. 50% D. 57%
B. 60% E. 50%
C. 64%
B. 60% E. 50%
C. 64%
Jawab
Diketahui: Mr metanol = Ar C + 4 × Ar H + Ar O
= 12 + (4 × 1) + 16
= 12 + 4 + 16
= 32 g/mol
= 12 + (4 × 1) + 16
= 12 + 4 + 16
= 32 g/mol
Mr air = 2 × Ar H + Ar O
Jadi, konsentrasi larutan metanol dalam persen berat adalah (C). 64%.
(UMPTN 1998)
Materi Lengkap Molalitas dan Fraksi Mol Beserta Contohnya - Mungkin sekian dulu ya pembahasan di pagi ini tentang Molalitas dan Fraksi Mol. Semoga pembahasan singkat diatas dapat bermanfaat bagi teman setia Sains Seru. Jika ada yang mau ditanyakan bisa tinggalkan di kolom komentar dibawah ya. Untuk pembahasan Sifat Koligatif Larutan Nonelektrolit dan Sifat Koligatif Larutan Elektrolit dapat ikuti terus update artikel disini ya. Terimakasih atas perhatiannya, See You.